المعادلات الكيميائية الرمزية تساعد على وصف التفاعلات إلا انها تفتقر إلى معلومات مهمة، يعتبر هذا السؤال من أسئلة مادة الكيمياء؛ كما أن السؤال السابق يأتي على شكل سؤال ضع اشارة صح أو خطأ أمام العبارات التالية؛، وان التعرف على اجابة هذه الأسئلة يكون من خلال قراءة السؤال بشكل دقيق وليتم اختيار الاشارة الصحيحة له، وهذا النوع من الأسئلة يجب على الطلاب لتعرف عليه وذلك من أجل الاستعداد للاختبارات؛ وللحصول على أعلى الدراجات؛ وهو ما يحافظ على تفوقهم الدراسي؛ ونحن هنا لكي نقدم لكم الاجابة الصحيحة؛ تابعوا معنا.
المعادلات الكيميائية الرمزية تساعد على وصف التفاعلات إلا انها تفتقر إلى معلومات مهمة.؟ العبارة صحيحة.
تعريف المعادلة الكيميائية
تعرف المعادلة الكيميائية على أنها عبارة عن تمثيل للتفاعل الكيميائي بواسطة مجموعة من الرموز والصيغ الكيميائية التي تعبر عن المواد الداخلة في التفاعل والخارجة منه والإلكترونات التي تكتسب أو تفقد من ذرات العناصر المتفاعلة؛ حيث أن المعادلة الكيميائية تبين تلك التغيرات التي تطرأ على المواد المتفاعلة وظروف التفاعل كما أنها تبين المعادلة حاجة التفاعل إلى حرارة وضغط وعوامل مساعدة.
كما يجب أن تكون المعادلة الكيميائية صحيحة الرموز والصيغ وأن تكون موزونة حيث أن مجموع كتل المواد المتفاعلة يساوي مجموع كتل المواد الناتجة من التفاعل؛ وعند كتابة معادلة يجب مراعاة الشحنة لأنها تلعب دوراً في عدد الإلكترونات المفقودة أو المكتسبة.
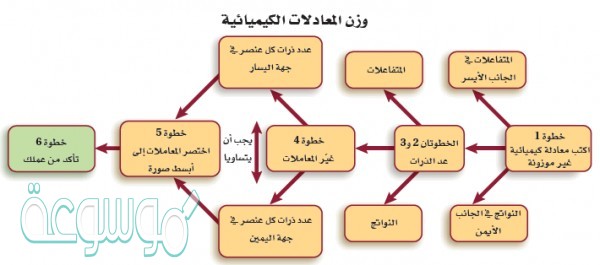
كيفية وزن المعادلات الكيميائية
ان عملية وزن المعادلة الكيميائية تتم في عدة خطوات متسلسلة، وهذه الخطوات هي كالآتي:
- أولا: يجب كتابة المعادلة الكيميائية التي يراد وزنها، مثلا كعملية حرق البروبان، حيث يتم التفاعل في وجود الأكسجين وينتج الماء، وثاني أكسيد الكربون كالاتي:
C3H8 + O2 —> H2O + CO2
- ثانيا: تتم كتابة عدد الذرات لكل عنصر في كلا جانبي المعادلة، وذلك بالنظر إلى الأجزاء المجاورة لكل ذرة لإيجاد عدد الذرات في المعادلة.
- عدد الذرات في الجانب الأيسر: عدد ذرات الكربون= 3، وعدد ذرات الهيدروجين= 8، وعدد ذرات الأكسجين= 2.
- عدد الذرات في الجانب الأيمن: عدد ذرات الكربون= 1، وعدد ذرات الهيدروجين= 2، وعدد ذرات الأكسجين= 3.
- ثالثا: قم بترك الأكسجين والهيدروجين لآخر خطوة في عملية الموازنة، وذلك كونهما شائعان في الجزيئات ومن المرجح أن يكونا على جانبي المعادلة.
- رابعا: البدء بموازنة العناصر المنفردة والتي تظهر على شكل جزئ واحد فقط في المواد المتفاعلة وجزئ واحد في المواد الناتجة، وفي المثال المستخدم البدء بموازنة ذرات الكربون أولاً.
- خامسا: إضافة معامل لذرة الكربون المنفرد في الجهة اليمنى لوزنها مع ذرات الكربون الموجودة في الجهة اليسرى من المعادلة كالآتي:
C3H8 + O2 —> H2O + 3CO2
- سادسا: موازنة ذرات الهيدروجين بعد الانتهاء من موازنة جميع الذرات الأخرى غير الأكسجين والهيدروجين، واستخدام معامل لوزنها، كما يلي:
- عدد ذرات الهيدروجين على الجانب الأيسر 8 ذرات، بينما عددها على الجانب الأيسر ذرتان، ولتحقيق الموازنة لا بد من إضافة المعامل للجهة اليمنى لوزن ذرات الهيدروجين.
- ضرب عدد ذرات الهيدروجين في الجانب الأيمن بالعدد 4، لتصبح عدد ذرات الهيدروجين متساوية على الطرفين، لتصبح المعادلة؛ كالاتي:
C3H8 + O2 —> 4H2O + 3CO2
- سابعا: وزن ذرات الأكسجين، مع الانتباه إلى المعاملات التي تمت إضافتها لموازنة الذرات الأخرى، مما أدى إلى تغيّر عدد ذرات الأكسجين.
- ثامناُ: أصبح بعد ذلك عدد الذرات متساوياً على الجانبين، وبهذا تكون المعادلة الكيميائية موزونة.